С возрастом суставная и хрящевая ткани человека теряют былую эластичность, утрачивают свою функциональность и разрушаются. Отсрочить подобные изменения можно с помощью ряда препаратов. Средством, помогающим поддержать функциональность хрящей и суставов, снять проявление симптоматики развивающихся заболеваний опорно-двигательной системы и повысить качество жизни пожилых людей, является глюкозамин хондроитин.
Что такое глюкозамин и хондроитин?
Разберемся, что из себя представляют такие моносахариды, как хондроитин и глюкозамин. Существует такое понятие, как хондроитинсульфат. Данное вещество относится к незаменимым компонентам хрящевой ткани, которое она вырабатывает самостоятельно. Соединение входит в состав заполняющей суставную сумку синовиальной жидкости. Эти факты говорят о том, что от наличия хондроитина зависит полноценная работа суставов.
В качестве строительной базы хондроитина и суставной жидкости выступает глюкозамин. Его недостаток провоцирует дефицит хондроитинсульфата в хрящевых тканях. Последствием этого может стать появление боли и хруста в суставах.
Виды и отдельные представители хондропротекторов
За годы существования хондропротекторы претерпевали изменения. В результате на современном фармацевтическом рынке присутствуют препараты этой группы двух поколений. Представителями хондропротекторов 1-го поколения являются Алфлутоп и Румалон.
Например, Алфлутоп содержит вытяжку, полученную из смеси нескольких видов мелкой морской рыбы. Он успешно производится в Румынии в виде раствора для инъекций, т. е. предполагает внутривенный или внутрисуставный способ введения. Но при этом в виду отсутствия доказательной базы эффективности он отсутствует в перечне рекомендованных ВОЗ лекарственных средств, не имеет одобрения FDAи не освящен в Кокрановских обзорах.
Вслед за препаратами первого поколения появились средства на основе очищенных глюкозамина и хондроитинсульфата, таким образом сформировав 2-е поколение хондропротекторов. К его представителям принадлежат:
- Дона, Эльбона, Сустилак, Артракам, Сустагард Артро (содержат исключительно глюкозамин);
- Мукосат, Артра, Структум, Хондрогард (содержат только хондроитинсульфат);
- Терафлекс, Стопартрит, Хонда, Хондро, Хондроглюсид (содержат оба действующих вещества).
Впоследствии производители пошли дальше и создали хондропротекторы 3-го поколения. Ярким представителем этой группы является Терафлекс Адванс. Его главным отличием от более старых средств является включение в состав, помимо глюкозамина и хондроитина сульфата, ибупрофена.
К слову, ибупрофен – соединение, относящееся к группе НПВС, прошедшее множество исследований и имеющее весомые доказательства выраженного противовоспалительного, жаропонижающего и обезболивающего действия. С ним близко знакомы все дети, молодые родители и люди более старшего возраста, так как именно он является основным компонентом широко известного препарата Нурофен.
Это ставит в тупик, так как Терафлекс Адванс действительно способствует уменьшению выраженности болевых ощущений, воспаления и общему улучшению состояния. В то же время непонятно: зачем платить в сотни раз больше за копеечный ибупрофен?
По аналогии с Терафлекс Адвансом на фармацевтический рынок вышли Артрокера, Артродарина, Диартрина, Дифлекса и т. д. В их состав в роли действующего вещества введен непопулярный в народе представитель все той же группы НПВС диацереин. Он обладает хорошими противовоспалительными и обезболивающими свойствами, что обуславливает эффективность приема этих препаратов. Но они не оказывают никакого непосредственного влияния на состояние хряща, его питание и защиту. Поэтому абсолютно неясно, почему они позиционируются в качестве хондропротекторов, если, по сути, являются препаратами фармакологической группы НПВС.
Отдельные случаи: Инолтра и Пиаскледин
Инолтра в США позиционируется в качестве нутрицевтика, т. е. своеобразной пищевой добавки, способной оказывать лечебное действие на организм. В ее состав входят:
- глюкозамин и хондроитинсульфат;
- полиненасыщенные жирные кислоты;
- аспартат марганца;
- витамины С и Е.
Поскольку Инолтра это БАД, она не нуждается в доказательствах эффективности и может свободно реализовываться повсеместно.
Особенно интересным препаратом является Пиаскледин. Он производится в форме капсул для перорального употребления, а в роли действующих веществ используются масла авокадо (100 мг) и соевых бобов (200 мг). Цена упаковки, содержащей 30 капсул, составляет примерно 20 $.
Если подсчитать, сколько масел содержится во всех 30-ти капсулах, и сопоставить со стоимостью 100 г каждого, без проблем отпускаемого в каждой аптеке, то их общая цена составит около 340 рублей. Таким образом, стоимость Пиаскледина завышена примерно в 60 раз и его можно без потери эффективности заменить теми же маслами, приобретенными в аптеке. Достаточно просто капнуть несколько капель в салат, на кусочек хлеба, сахара и т. д.
Но опять же, нет никаких доказательств, что масла авокадо и соевых бобов приводят к улучшению обмена веществ в хрящевой ткани, способствуют уменьшению воспалительных процессов, устранению болей и т. д.
Чем отличается глюкозамин от хондроитина?
Один из вопросов, с которым сталкиваются люди перед применением препаратов – в чем отличие глюкозамина от хондроитина? Эти вещества обладают одинаковой структурой. Важно знать, что глюкозамин является обязательной составляющей хондроитина, которая дополняет его и усиливает свойства. Совокупность этих веществ позволяет улучшить их усвоение, обеспечить эффективную защиту и активное восстановление хрящей. Большая часть хондопротекторов представляет собой препараты, состоящие лишь из этих компонентов. Существуют также средства, в которых хондроитин и глюкозамин дополняют состав.
Свойства, польза и роль для организма человека
Говоря о том, для чего принимают глюкозамин хондроитин, стоит обратиться к исследованиям ученых. При длительной терапии препаратами, в состав которых входит данное соединение, отмечается снятие болевого синдрома при гонартрозе у пожилых пациентов. Их качество жизни улучшается, так как суставы становятся более функциональными. Потребность в препаратах нестероидной группы противовоспалительного действия в данном случае снижается (). Свойства глюкозаминхондроитина позволяют выполнять препаратам, в состав которых они входят, и такие функции:
- обеспечение регенерации вышедших из строя и поврежденных тканей;
- сопровождение процесса клеточного питания;
- профилактика образования пигментных пятен;
- борьба с воспалительными процессами в желудочно-кишечном тракте;
- сохранение структуры тканей на молекулярном уровне;
- предупреждение появление сосудистых бляшек.
Наблюдения ученых позволили прийти к мнению, что глюкозамин хондроитин эффективен в качестве средства против остеоартроза. Механизм его действия основан на запуске активной выработки протеогликанов, имеющих здоровую структуру. Польза глюкозаминхондроитина состоит и в том, что он препятствует разрушению хрящевой ткани за счет угнетения активности матриксной металлопротеиназы. Данное соединение способствует также предотвращению распространения воспалительных процессов ().
Какой хондропротектор лучший
Лучший хондропротектор для вашего конкретного случая сможет подобрать только ваш лечащий врач. На нашем сайте представлена информация о препарате Артра®, который производится в США при строгом контроле качества. В составе препарата присутствует высокие концентрации глюкозамина и хондроитина, что обеспечивает комплексное действие. Выпускается средство в таблетированной форме для приема внутрь. Прием удобный, всего 1 раз в день, а это так важно.
- Ильин, Д. П. Болезни суставов и спины в пожилом возрасте / Д.П. Ильин. — М.: Вектор, 2011. – с. 100-105
- Мазнев, Н. Артрит, артроз, подагра. Болезни суставов. Авторские методики лечения / Н. Мазнев. — М.: Рипол Классик, Дом. XXI век, 2010. – с. 488-500
- Покровский, Борис Болезни суставов / Борис Покровский. — М.: Лада, АСС-Центр, 2011. – с. 645-648
- Родионова, О. Н. Болезни суставов / О.Н. Родионова. — М.: Вектор, 2012. – с. 245-252
- Уорралл, Дженнифер Артрит и другие болезни суставов. Все, что нужно знать / Дженнифер Уорралл. — М.: АСТ, Астрель, 2015. – с. 124-128
- Бадокин В.В., Эффективная фармакотерапия, 38/2013. –с.68–75
- Каратеев Е.А. и соавт., Применение НПВП. Клинические рекомендации, ИМА-Пресс, М., 2009. – с. 58-59
- Болезни суставов. Руководство для врачей / под ред. В. И. Мазурова. — 2008. — с 300-305.
Показания к приему и инструкция по применению
Согласно инструкции по применению глюкозамин хондроитин назначается в случае диагностирования остеоартрита, тендинита, остеоартроза и дискоза. Рекомендуется применять препараты с этим соединением людям, склонным к получению травм, например вывихов и переломов. Глюкозамин хондроитин необходимо использовать людям, которые занимаются тяжелой атлетикой, пауэрлифтингом или бодибилдингом. Их организм подвержен большим физическим нагрузкам, после которых ему необходима помощь в восстановлении.
Популярные формы выпуска
Глюкозамин хондроитин выпускается в виде средств наружного и внутреннего применения. Это могут быть кремы, мази, капсулы, таблетки и порошки. Средства для наружного применения не всегда дают ожидаемый результат и действуют не так быстро, как препараты, которые нужно пить. Таблетки могут быть немного менее эффективными, чем капсулы, так как часть действующего вещества растворяется по дороге к кишечнику, из-за чего теряет свою пользу. Кроме того, таблетированная форма препарата может спровоцировать раздражение кишечника. Капсулы более эффективны и безопасны. Они не содержат в себе дополнительных компонентов, провоцирующих побочные реакции со стороны ЖКТ, и в целостности доставляют действующее вещество к желудку, через стенки которого оно полностью всасывается в кровоток. Порошки удобнее применять, если трудно глотать таблетки или капсулы.
При каких заболеваниях применяют хондропротекторы
Препараты назначаются при всех заболеваниях сочленений. При артрите (артрозе) любой этиологии и ревматоидном поражении полезен препарат профилактический, например, хондропротектор. Воспаление при этих болезнях впоследствии ведет к разрушению хряща. Средства для лечения назначаются курсом один раз в полгода, это предотвращает деструкцию хрящевой ткани или восстанавливает повреждение.
Если артрит (артроз) вызван инфекционным агентом, необходимы не только антибактериальные средства, но и препарат для защиты гиалина, так как часто бактерии, вирусы и грибки вызывают разрушение хряща.
Лечение происходит разными формами лекарственных средств: таблетками, уколами, мазями. Врач назначает средство и способ доставки.
Межпозвонковая грыжа лечится хондропротекторами. Но усложняет терапию то, что кровоток в области хрящей межпозвоночных сочленений недостаточный.
Помогают при остеохондрозе, особенно на начальных стадиях, когда отсутствуют дегенеративные изменения. Лекарственные средства назначаются местно, в виде мазей или в таблетках.
При подагрическом артрите стоит пропить курс до разрушения хряща. Так как постепенно происходит деструкция хрящевой ткани.
В комплексном лечении гонартроза (артроз коленного сустава) применяются средства данной группы.
Как пить глюкозамин хондроитина: норма в день, дозировки
Глюкозамин хондроитин – препарат накопительного действия, из-за чего длительность его применения может составлять до 12 месяцев в зависимости от клинической картины. Спортсменам рекомендуется пить по 1500 мг препарата, в 2 или 3 приема. Максимальная суточная доза глюкозамина и хондроитина для человека составляет 2000 мг. Препарат начинают принимать в небольшом количестве, равном 400 мг, увеличивая дозировку согласно схеме приема. Его выпивают во время или после еды, так как на голодный желудок действие активного вещества замедляется.
В чем же проблема современных хондропротекторов?
Даже высокая рыночная стоимость хондропротекторов не представляла бы большой проблемы, если бы они были весьма эффективными. Но, к сожалению, они не могут соответствовать заявленным свойствам, поскольку попадающие в кровоток из ЖКТ глюкозамин и хондроитинсульфат не способны проникать из крови в суставную жидкость. В таком случае каждое желе, холодец или заливное были бы не менее эффективными.
Проверить характер распределения любого вещества в организме после его введения любым способом легко при помощи простого в исполнении радиоизотопного метода. Его суть состоит в обработке препарата безвредной для организма человека радиоактивной меткой с короткой продолжительностью существования. Путем рентгеновского исследования можно точно установить, как он распределяется в организме. Если будет обнаружено скопление частиц препарата в области суставов, это станет полноценным доказательством его эффективности.
Но фармацевтические компании не спешат воспользоваться этим методом и находят множество отговорок. Действительность такова, что в США глюкозамин признан пищевой добавкой. А проведенные независимые исследования хондроитина сульфата показывают, что его эффективность сравнима с эффектом плацебо.
Единственными данными исследований, на которые опираются производители хондропротекторов, получались путем субъективной оценки боли пациентами по визуально-аналоговой шкале. Подобное не может подтверждать присутствие какого-либо терапевтического эффекта от приема хондропротекторов, кроме эффекта плацебо.
Говорить об их результативности можно было бы, если предоставить мировому медицинскому сообществу данные радиоизотопного исследования или показать, что после приема хондропротекторов наблюдается хотя бы минимальное увеличение толщины истонченных межпозвоночных дисков.
Противопоказания и побочные эффекты
Нельзя принимать препарат при индивидуальной непереносимости, а также в случае беременности или кормления грудью.
Противопоказаниями к применению глюкозамин хондроитина становятся также:
- несовершеннолетний возраст;
- нарушение свертываемости крови;
- диагностирование сахарного диабета;
- наличие астмы или гипотонии;
- нарушение работы сосудов, в том числе тромбообразования.
Говоря о том, эффективен ли глюкозамин хондроитин, стоит принять во внимание накопительный эффект препаратов. Для того чтобы терапия принесла результат, нужно принимать средство на протяжении не менее чем 6 месяцев. Выяснить, насколько безопасен длительный прием средств, помогли тщательные исследования. Отмечается, что эффективное снятие болевого синдрома и восстановление функциональности суставов наблюдается как во время приема препаратов без перерывов, так и при их использовании курсами по 3 месяца с перерывами той же длительностью. Побочные действия глюкозамин хондроитина наблюдались в единичных случаях. Среди них боли в животе после отмены приема и папулезная сыпь во время применения (). В некоторых случаях препараты способны вызвать тошноту, рвоту и диарею.
Специалисты
Blair Yasso1, Yinghe Li2, Asafov Alexander3; Мельникова Н.Б.4, Мухина И.В.5
1 MB Research Laboratories, 1765 Wentz Road, Spinnerstown, PA 18968, USA, Blair Yasso, B.S., Study Director;
2 Alliance Pharma, Inc., 17 Lee Blvd, Malvern, PA 19355, USA, Yinghe Li, Bioanalytical Principal Investigator;
3 Foura Pacific Pte Ltd, (Singapore), 35 Selegie Road #10-05, Parklane Shopping Mall, Singapore 188307, Asafov Alexander, R&D, CEO;
4 Кафедра фармацевтической химии ГБОУ ВПО НижГМА Минздрава России (заведующий кафедрой – профессор, д.х.н. Мельникова Н.Б., г. Нижний Новгород, ул. Родионова, 293)
5 Центральная научно-исследовательская лаборатория ГБОУ ВПО НижГМА Минздрава России (заведующий ЦНИЛ – профессор, д.б.н. Мухина И.В., г. Нижний Новгород, пр. Гагарина, 70)
Ключевые
cлова
: относительная биодоступность, глюкозамина сульфат, трансдермальный глюкозаминовый комплекс, мицеллярная трансдермальная система доставки.
РЕЗЮМЕ
Проведено сравнение относительной биодоступности и интенсивности проникания глюкозамина сульфата при пероральном, инъекционном применении и местном введениипрепарата Хондроксид® Максимум в виде крема, содержащего мицеллярную систему трансдермальной доставки глюкозамина, в эксперименте на крысах линии Спраг-Доули. На основе анализа фармакокинетических профилей глюкозамина в плазме крови крыс установлено, что при введении ежедневно 3 раза в день в течение недели крема Хондроксид® Максимум в дозе 400 мг/кг и разовой инъекции 4% раствора Глюкозамина сульфата в дозе 400 мг/кг относительная биодоступность составляла 61,6 %. Рассчитаны средняя скорость проникания глюкозамина в плазму крови через кожу крыс за 4 часа, равная 26,9 мкг/см2∙ч, и доля проникания глюкозамина из крема через кожу в плазму крови животного при однократном введении за 4 часа, которая составила 4,12 %.
Сопоставительный анализ литературных и экспериментальных данных, а также расчеты на их основе, позволили сделать вывод, что, в процессе лечения в соответствии с инструкцией на препарат Хондроксид® Максимум, расчетная средняя концентрация глюкозамина в синовиальной жидкости воспаленного сустава может составлять величину (0,7–1,5) мкг/мл, что в 10-75 раз выше концентрации эндогенного глюкозамина в синовиальной жидкости сустава человека (0,02-0,07) мкг/мл. Эта величина сравнима с уровнем, достигаемым инъекционными формами глюкозамина и превышает до 2 раз уровень, достигаемый пероральными формами глюкозамина.
ВВЕДЕНИЕ
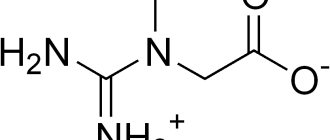
Глюкозамин (2-амино-2-дезокси-D-глюкоза) надежно зарекомендовал себя в качестве хондропротектора в профилактике и лечении нарушений метаболизма костной и соединительной тканей, в частности в коллагеновом и хрящевом матриксах. По данным обзора Р.Д. Альтмана глюкозамин в качестве лекарственного средства продемонстрировал симптоматический и модифицирующий течение остеоартрита эффект. Глюкозамин в этом случае является специфическим субстратом и стимулятором синтеза эндогенных гликозаминогликанов (гиалуроновой кислоты, хондроитинсульфата А и С, дерматансульфата, кератансульфата, гепарина и гепарансульфата) и, соответственно, протеогликанов, которые наряду с гиалуроновой кислотой являются одним из основных компонентов – строительных элементов внеклеточного матрикса соединительной ткани. Недостаток эндогенного глюкозамина вызывает воспалительные и дегенеративные изменения, поэтому большое влияние на развитие и течение таких заболеваний оказывает концентрация глюкозамина в синовиальной жидкости, которая может быть восполнена введением глюкозамина в плазму крови одним из рассматриваемых здесь путей.
Современными исследованиями выявлены новые дополнительные положительные эффекты от введения глюкозамина, в том числе нормализация активности ферментов за счет антиоксидантной защиты супероксиддисмутазы и каталазы, ингибирование процессов образования малонового диальдегида и диеновых конъюгатов – промежуточных этапов окисления коллагена, положительное влияние на активность NO-синтазы, генерирующей монооксид азота, при участии которого синтезируется глюкозамин, восполнение дефицита сульфат ионов, необходимых для синтеза специфических гликозаминогликанов.
Препараты глюкозамина широко представлены пероральными, инъекционными и наружными лекарственными формами, содержащими глюкозамина гидрохлорид или глюкозамина сульфат, предполагающие разовую дозу от 100 до 1500 мг. Причиной, ограничивающей использование пероральных препаратов глюкозамина в практике, является необходимость использования высоких концентраций глюкозамина при длительном приеме для обеспечения необходимой биодоступности, что может привести к проантиоксидантному эффекту. Существующие наружные лекарственные формы (крем, мазь, эмульсия, гель), имеющие в своем составе глюкозамин не располагают эффективным механизмом его переноса к синовиальной мембране, окружающей пораженное место. Поэтому несмотря на высокую потенциальную эффективность глюкозамина, лечебный эффект классических местных средств сильно уступает пероральной форме. Инъекционные препараты, при их максимальной биодоступности, ограничены самим методом введения, приемлемым не для всех пациентов, а также необходимостью их применения с участием профессионального медицинского персонала.
Одним из способов улучшения биодоступности глюкозамина из наружных препаратов является введение в состав лекарственной формы системы трансдермальной доставки этого соединения,. Представителем таких препаратов с улучшенной биодоступностью является препарат Хондроксид® Максимум, содержащий мицеллярный трансдермальный глюкозаминовый комплекс (ТГК), как систему эффективной доставки глюкозамина в кровь и ткани сустава. Достижение высокой проникающей способности ТГК через кожу обусловлено размером мицелл 20-80 нм и участием в образовании мицеллярной системы триглицеридов, усиливающих липофильность частиц дисперсной фазы в прямой эмульсии крема.
К сожалению, до настоящего времени, фармакокинетические исследования, позволяющие выявить преимущества использования такого трансдермального комплекса и сопоставить его действие с пероральными и инъекционными формами, отсутствовали, что затрудняло масштабное внедрение этого препарата в практику.
Целью исследования
являлось сравнительное экспериментальное изучение относительной биодоступности и интенсивности проникания глюкозамина сульфата при его пероральном и инъекционном введении и местном введениипрепарата Хондроксид® Максимум ТГК в эксперименте на крысах линии Спраг-Доули, а также прогнозирование содержания глюкозамина в синовиальной жидкости воспаленного сустава человека.
МАТЕРИАЛЫ И МЕТОДЫ
Экспериментальные исследования проведены в лаборатории MB Research Laboratories Spinnerstown, PA (США) с привлечением аналитической лаборатории Alliance Pharma, Inc., Malvern, PA (США) в соответствии с Положениями и принципами действующих правил GLP (Good Laboratory Practices), Агентства о защите Окружающей среды (EPA), 40 CFR Часть 160 и 792, Управления Контроля Продуктов и Лекарств (FDA), 21 CFR Часть 58, и ОЭСР.
Сравнительную биодоступность глюкозамина при пероральном, инъекционном и местном введениив экспериментеизучали, используя для перорального применения и внутримышечного ведения 4% водный раствор Глюкозамина сульфата калия хлорида (40 мг сухого порошка Глюкозамина сульфата/мл), в качестве растворителя выступала дистиллированная вода и стерильная вода для инъекции соответственно. Для изучения наружного применения наносили препарат Хондроксид® Максимум (Licht Far East (S) Pte. Ltd., Сингапур) в виде крема, содержащий систему трансдермальной доставки глюкозамина в виде мицелл. В состав крема (в расчете на 100 г) входят: глюкозамина сульфат калия хлорид 8,0 г, вспомогательные вещества, в частности, диметилсульфоксид — 1,0 г, аскорбиновая кислота – 0,1 г и формообразующие ингредиенты. Эксперименты проведены на восьминедельных крысах самцах Спраг-Доули (Sprague—Dawley) массой 250±25 г (n=45, число животных в каждой группе 9 – минимально достаточное количество, необходимое для возможности взятия по 3 анализа на каждую временную точку (0 ч, 0,5 ч, 1 ч, 2 ч, 4 ч, 6 ч) и получения статистически значимых данных). По окончании эксперимента животные подвергались эвтаназии с СО2 камере.
Доза исследуемого препарата Хондроксид® Максимум в виде крема по действующему веществу составила 400 мг/кг или по лекарственной форме 5 г/кг (102 мг/крысу). Препарат применялся наружно в виде накожной аппликации и легкого втирания в область спины, с плеч до тазовой кости и вниз от спины до живота с обеих сторон животного, общей поверхностью 39 см2. Место применения оставалось непокрытым.
Доза исследуемого 4% раствора Глюкозамина сульфата калия хлорида для применения внутрь по действующему веществу составила 400 мг/кг (88,8 мг/крысу). 4% раствор глюкозамина сульфата вводился перорально в объеме 10 мл/кг.
Доза исследуемого 4% раствора для инъекций составила 400, 100 и 25 мг/кг (соответственно 102,4, 25,9 и 6,2 мг/крысу). Препарат вводился внутримышечно в объемах 10, 2,5 и 0,625 мл/кг 4% раствора глюкозамина сульфата, соответственно.
Сбор образцов и подготовка плазмы для проведения анализов осуществлялись согласно следующей схеме: 0,5 мл цельной крови при помощи прямой венепункции хвоста крысы отбиралось в пробирки, содержащие ЭДТА в качестве антикоагулянта. Образцы крови центрифугировали для отделения плазмы, которая была затем разделена на две равные части и помещена в две предварительно промаркированные полипропиленовые криогенные пробирки с завинчивающимися крышками. Все собранные образцы плазмы хранились при -70±50C до момента отправки ночным курьером (на сухом льду) в лабораторию Alliance Pharma, Inc. (Malvern, PA, США) для проведения анализа. Анализ образцов плазмы крови животных на содержание глюкозамина проводили методом жидкостной хроматографии – тандемной масс-спектрометрии (LC-MS/MS) с учетом принципов, подробно описанных в статье Liang Zh. et al.. В качестве детектора на жидкостном хроматографе Shimadzu Prominence LC (Япония) использовали совместимый масс-спектрометр Sciex API 4000 QTrap (США). Хроматограммы анализировали с помощью программы Analyst 1.4.2. В качестве калибровочного стандарта использовали D-Glucosamine Hydrochloride (Toronto Research Chemicals. Inc., Lot number 13-XJZ-183-1, чистота 98%), внутренний стандарт – D-Glucosamine-l,2-IJC2 Hydrochloride (10 мкг/мл, Toronto Research Chemicals, Inc., Lot number 6-SXG-29-1, чистота 98%). Для построения калибровочного графика для глюкозамина использовался регрессионный метод, при этом нижний уровень определения концентрации глюкозамина в плазме крови для разработанного метода составлял величину 0,4 мкг/мл.
Из фармакокинетических кривых определяли основные фармакокинетические характеристики: Стах
– максимальную концентрацию лекарственного вещества в крови; С4 часа – среднюю концентрацию лекарственного вещества в крови за первые 4 часа;
tmax
– время достижения максимальной концентрации; AUCt — площадь под кинетической кривой «концентрация – время» (
англ.
area under curve). Для расчета биодоступности использовалась только AUCt.
Для оценки биоэквивалентности препарата Хондроксид® Максимум в виде крема с действующим веществом Глюкозамина сульфатом калия хлоридом в сравнении с 4% раствором для применения внутрь и 4% раствором для инъекций Глюкозамина сульфата был проведен статистический анализ полученных фармакокинетических данных (среднее значение, стандартное отклонение, точность) с использованием программного продукта Watson LIMS™ для биоаналитических лабораторий и согласно Руководству по проведению доклинических исследований лекарственных средств.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
На первом этапе был исследован фармакокинетический профиль глюкозамина в плазме крови крыс при однократном местном введении крема Хондроксид® Максимум (в дальнейшем «крем») на область спины в размере 400 мг/кг (табл. 1).
Сопоставление инъекционного метода введения с местным проведено на трех уровнях дозы – 400 мг/кг (102,0 мг/крысу), 100 мг/кг (25,9 мг/крысу), 25 мг/кг (6,2 мг/крысу), отражающих диапазон, в которых у крыс данного вида реализуется желаемый эффект глюкозамина без признаков побочного действия. Из данных рисунка 1(Б) видно, что в этом интервале доз сохраняется линейность фармакокинетики. Максимальная концентрация Cmax местного нанесения равная 7,31 мкг/мл наиболее приближена к Cmaxравному 13,05 мг/мл, определенной по фармакокинетической кривой при внутримышечном введении в дозе 25 мг/кг (6,2 мг/крысу); величины AUCt равны 7,35 мкг∙ч/мл и 10,8 мкг∙ч/мл, соответственно (табл. 1).
Сравнение перорального (400 мг/кг), внутримышечного (25 мг/кг) и местного (400 мг/кг) введения продемонстрировано в таблице 1. Из данных таблицы 1 видно, что Cmax глюкозамина в плазме крови при внутримышечном (в/м) введении достигалась через 0,5 часа, при местном введении через 1 час и при пероральном введении – через 1,5 часа.
Учитывая вышеизложенные факты, для расчета относительной биодоступности крема с дозой 102,0 мг/крысу при однократном введении были использованы данные по внутримышечному введению 4% водного раствора глюкозамина с дозой 6,2 мг/крысу.
| А | Б |
| В | |
Рисунок 1. Концентрация глюкозамина в плазме крови крыс Sprague—Dawley при различных способах введения. По оси ординат – концентрация глюкозамина в мкг/мл,
по оси абсцисс – время взятия пробы крови
Таблица 1.
Фармакокинетические параметры глюкозамина в плазме крови крыс при однократном применении
| Расположение кривых, рис. 1 (А, Б, В) | Препарат | Доза на крысу по ЛФ, мг | Фармакокинетические параметры | |||
| Cmax мкг/мл | С4 часа, мкг/мл | AUCt мкг∙ч/мл | tmax, ч | |||
| 1(А), 1(В) | Крем Хондроксид® Максимум (спина) | 102,0 | 7,31 | 1,84 | 7,35 | 1,0 |
| 1(В) | 4% раствор для применения внутрь | 88,8 | 11,7 | 4,93 | 19,7 | 1,5 |
| 1(Б) | 4% раствор для инъекций (10 мл) | 102,4 | 290,7 | 62,6 | 250,4 | 0,5 |
| 1(Б), 1(В) | 4% раствор для инъекций (0,625 мл) | 6,2 | 13,05 | 2,7 | 10,8 | 0,5 |
Для выбора критерия сравнительной оценки местного введения по отношению к другим способам был выполнен приближенный расчет массы глюкозамина (ГА) в плазме крыс при однократном введении (СГА, мг), используя отношение AUCtop к AUCх, и массу глюкозамина в одной дозе при определенном способе введения mГА(x):
СГА, мг = (AUCtop/ AUCх)* mГА(x),
где AUCх представляет значения:
AUCin,max – AUC при инъекционном введении с максимальной дозой 102 мг на 1 крысу;
AUCin,min – AUC при инъекционном введении с дозой 6,2 мг на 1 крысу;
AUCperos – AUC при пероральном введении с дозой 88,8 мг на 1 крысу.
Таблица 2
Сравнительная характеристика методов введения
| Введение | Сравнение | AUCtop/ AUCх | СГА, мг |
| Местно 400 мг/кг (102 мг) | Инъекционно 400 мг/кг mГА =102 мг | 7,35/250,4 | 3,0 |
| Местно 400 мг/кг (102 мг) | Инъекционно 25 мг/кг mГА =6,2 мг | 7,35/10,8 | 4,2 |
| Местно 400 мг/кг (102 мг) | Перорально 400 мг/кг mГА =88.8 мг | 7,35/19,7 | 33,1 |
Из данных таблицы 2 следует, к примеру, что однократное нанесение крысе крема массой 1,28 г (доза глюкозамина 102 мг) соответствует однократному введению инъекционно 4% раствора глюкозамина в количестве 4,2 мг.
РАСЧЕТ СРАВНИТЕЛЬНОЙ БИОДОСТУПНОСТИ ЧЕРЕЗ КОЖУ ЧЕЛОВЕКА
Проникание глюкозамина из крема через кожу площадью 39 см2 в плазму крови оценивали через долю α, % и удельную скорость проникания υпр (удельная диффузия)
Доля проникания глюкозамина α (%) крема массой m при однократном местном введении через кожу в плазму за 4 часа равнялась:
α, % = (СГАв плазме, мг/ m, мг)*100 = 4,2/102 *100 = 4,12%,
а удельная скорость проникания υпр. глюкозамина соответствовала 26,9 мкг/см2/ч:
υпр = (СГА (6,2мг)в плазме, мкг/ Sкожи, см2)/ 4 ч = (4200мкг /39 см2)/4ч = 26,9 мкг/см2/ч
Величину α, % можно рассматривать как биодоступность глюкозамина за 4 часа после нанесения крема.
Для прогнозирования проникания β invivo глюкозамина из препарата Хондроксид® Максимум в кожу человека использовали следующее уравнение полученное авторами статьи:
β invivoчеловека = К′эф * υinvivoкрысы,
где К′эф = υinvitroчеловека/υinvitroкрысы ≈ 0,3-0,5, определенная в эксперименте в диффузионной камере методом диализа; υinvivoкрысы = 26,9 мкг/см2/ч.
В соответствии с вышеприведенной зависимостью удельная скорость проникания (диффузии) глюкозамина в плазму крови при нанесении препарата Хондроксид® Максимум на кожу человека составила величину β invivoчеловека =(8,1-13,5) мкг/см2/ч.
ПРОГНОЗ КОНЦЕНТРАЦИИ ГЛЮКОЗАМИНА В СИНОВИАЛЬНОЙ ЖИДКОСТИ
Полученная нами приближенная оценка удельной скорости переноса глюкозамина из крема в плазму крови υinvivoкрысы , равная 26,9 мкг/см2/ч сопоставима с величиной скорости чрезкожного переноса из раствора глюкозамина в кожу в экспериментах in vitro в модельной диффузионной ячейке υinvitro=19,2±0,6 мкг/см2/ч. Удельная скорость переноса в этих модельных условиях глюкозамина в креме другого состава с трансдермальной системой доставки лежит в интервале от 23,5±2,3 до 48,2±1,9 мкг/см2/ч. Учитывая, что в реальных условиях эксперимента in vivo на крысах υ invivo, почти равна средней величине υ invitro, определеннойв диализной ячейке, можно считать нашу приближенную оценку υ=26,9 мкг/см2/ч, как величину, характеризующую эффективное проникание глюкозамина из крема через кожу в плазму крови.
Сопоставление данных анализа фармакокинетических профилей глюкозамина для плазмы крови человека, полученных в работе при однократном пероральном применении в дозе 1500 мг, и плазмы крови крыс при наружном нанесении крема Хондроксид® Максимум в нашей работе, свидетельствует о высокой биодоступности глюкозамина из исследуемого препарата. Фармакокинетические параметры – AUCt (мкг*ч/мл) при пероральном введении человеку равен 3,6±0,72, а при наружном нанесении крема крысе равен 7,35±1,48; Cmax, мкг/мл равна 0,49±0,16 (перорально для человека) и 7,31±2,08 (местно, крема Хондроксид® Максимум для крыс).
Приближенно рассчитанная величина β invivoчеловека может быть использована для оценки уровня концентрации глюкозамина в плазме крови сосудов микроциркуляторного русла, окружающих сустав. Например, по инструкции к препарату Хондроксид® Максимум в виде крема с ТГК количество наносимого крема составляет полоску крема длиной до 3 см, что примерно соответствует 3 – 3,5 г. При сохранении удельной величины наносимого на кожу крема, используемой в эксперименте на животных в течение 4 часов, площадь для нанесения крема составит 106 см². Количество глюкозамина, доставленного в плазму крови через капилляры сосочкового слоя дермы, составит величину: (8,1 – 13,5) мкг/см²/час * 106 см² * 4 ч = (3434 – 5724) мкг.
Принимая объем циркулирующей крови у человека равным в среднем 5500 мл, самая пессимистическая (без учета прямого проникновения глюкозамина в составе ТГК через кожу к синовиальной мембране) оценка величины средней концентрации глюкозамина в плазме крови сосудов микроциркуляторного русла, окружающих сустав, в течение 4 часов будет составлять величину: (3434 – 5724) мкг / 5500 мл = (0,62 – 1,04) мкг/мл.
При лечении остеоартрозов инъекционным препаратом на основе глюкозамина (ЛСР-000050 от 26.12.2007), курс лечения составляет 3 инъекции внутримышечно в неделю по 3 мл с содержанием глюкозамина 400 мг в одной инъекции или 0,072 мг/мл плазмы крови.
Биодоступность при инъекционном введении глюкозамина на модели крупного животного.
По данным авторов пиковая концентрация (Сmах) глюкозамина в плазме при однократном в/в введении здоровой лошади из расчета 0,2 мг на 1 мл плазмы крови, достигала 50 мкг/мл, средняя концентрация глюкозамина в плазме крови за 12 часов составляла 4,5 мкг/мл, а пиковая концентрация глюкозамина в синовиальной жидкости составляла 1,5 мкг/мл при средней концентрации глюкозамина в синовиальной жидкости за 12 часов 0,7 мкг/мл.
Следует отметить, что при проникновении глюкозамина из плазмы крови в синовиальную жидкость, уровень максимальной концентрации глюкозамина в синовиальной жидкости воспаленного сустава, в соответствии с полученными экспериментальными данными, может быть до 5 раз выше, чем в интактном суставе. Приведенные данные позволяют с большой долей уверенности считать, что при остеоартрозе разных стадий пиковая концентрация глюкозамина в синовиальной жидкости воспаленного сустава лошади при в/в введении может доходить до величины 7 – 8 мкг/мл.
Биодоступность при инъекционном введении глюкозамина человеку.
Учитывая, что инъекция глюкозамина человеку проводится в концентрации в 3 раза ниже, чем в модели, рассмотренной выше (0,072 мг на 1мл плазмы крови), пиковая концентрация глюкозамина в плазме крови при разовой инъекции составит величину приблизительно 15 – 20 мкг/мл, средняя концентрация в плазме в течение 12 часов после инъекции при этом составит величину около 1,5 – 1,7 мкг/мл, а средняя концентрация глюкозамина в синовиальной жидкости здорового сустава человека составит величину 0,25 – 0,3 мкг/мл.
Биодоступность при пероральном введении глюкозамина человеку.
При приеме внутрь взрослым при остеоартрозе назначается максимальная доза 1500 мг глюкозамина в сутки, что составляет 0,2 мг/мл плазмы крови. Глюкозамин принимают внутрь в виде капсул или приготовленного водного раствора. Рекомендованная продолжительность терапии, в зависимости от тяжести заболевания, составляет от 4 до 12 недель. По данным авторов при введении 1500 мг глюкозамина человеку однократно пиковая концентрация глюкозамина в плазме крови человека достигает 1,6 мкг/мл к 3 часу после момента приема, средняя площадь под кривой зависимости концентрации от времени в течение периода 48 часов составляет 14,6 мкг* час/мл, тогда средняя концентрация от разового приема глюкозамина в дозе 1500 мг в течение 48 часов составит величину 0,3 мкг/мл. Соответственно, доза 1500 мг, принимаемая каждые сутки даст среднюю концентрацию в плазме крови человека не более 0,6 мкг/мл. Более поздняя работа тех же авторов показывает, что при введении перорально дозы 1500 мг глюкозамина, ежедневно, в течение 14 дней, в плазме крови и синовиальной жидкости сустава человека происходит накопление глюкозамина и на 14-й день средняя концентрация глюкозамина в плазме крови возрастает от эндогенного уровня концентрации 0,052 мкг/мл до 1,28 мкг/мл, в синовиальной жидкости сустава, соответственно от 0,037 мкг/мл до 0,78 мкг/мл. Другими словами, средняя концентрация глюкозамина в плазме крови после 14 дневного приема возрастает примерно в 20 раз по сравнению с эндогенным уровнем концентрации глюкозамина и в 2 раза по сравнению с уровнем средней концентрации глюкозамина, достигаемым после разового приема. Средняя концентрация глюкозамина в синовиальной жидкости после 14 дневного приема возрастает также примерно в 20 раз.
Биодоступность при пероральном введении глюкозамина на модели крупного животного.
При введении лошади перорально глюкозамина, однократно, в дозе 0,2 мг/мл, пиковая концентрация в плазме крови составляет величину 1,13 мкг/мл, средняя концентрация глюкозамина в плазме крови за 12 часов после введения составляет величину 0,4 мкг/мл, пиковая концентрация глюкозамина в синовиальной жидкости составляет величину 0,16 мкг/мл, средняя концентрация экзогенного глюкозамина в синовиальной жидкости составляет величину 0, 072 мкг/мл. С учетом того, что удельные дозы при пероральном введении лошади и человеку в рассматриваемых случаях равны (0,2 мг/мл), а параметры пиковой и средней концентрации глюкозамина в плазме крови очень близки, можно предположить, что у человека при разовом пероральном введении глюкозамина уровень средней концентрации глюкозамина в синовиальной жидкости будет составлять такую же величину 0,07 мкг/мл.
Тогда можно также сделать обобщающий вывод, следующий из всех вышеприведенных экспериментальных данных по биодоступности глюкозамина при пероральном введении лошади и человеку. При ежедневном введении глюкозамина перорально, в течение 14 дней, происходит накопление глюкозамина в плазме крови и синовиальной жидкости воспаленного сустава, средняя концентрация глюкозамина при этом, по сравнению с результатами, полученными при однократном введении, возрастает, соответственно, примерно в 2 раза в плазме крови человека от 0,6 мкг/мл до 1,28 мкг/мл и примерно в 11 раз в синовиальной жидкости воспаленного сустава человека от 0,07 мкг/мл до 0,78 мкг/мл.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На основе проведенных исследований и теоретических расчетов при однократном внутримышечном введении глюкозамина в составе 4% раствора Глюкозамина сульфата калия хлорид человеку в дозе 400 мг (0,072 мг/мл плазмы крови) пиковая концентрация глюкозамина в плазме, может быть оценена величиной 15 – 20 мкг/мл, что обеспечивает величину среднего уровня концентрации глюкозамина в синовиальной жидкости в течение первых 12 часов 0,25 – 0,3 мкг/мл для здорового сустава, и величину до 1,25 –1,5 мкг/мл для воспаленного сустава с периодом полувыведения около 68 часов. При многократном введении 3 раза в неделю, поскольку следующее введение происходит через 48 – 72 часов, концентрация глюкозамина в синовиальной жидкости до момента каждого следующего введения падает до уровня 0,6 – 1,0 мкг/мл, а средняя концентрация глюкозамина в синовиальной жидкости воспаленного сустава в течение курса лечения может быть оценена величиной 1,2 – 1,3 мкг/мл.
Таким образом, средняя концентрация глюкозамина в синовиальной жидкости воспаленного сустава в течение инъекционного курса лечения (3 инъекции в неделю, в/м, по 3 мл с содержанием глюкозамина 400 мг в одной инъекции) может быть оценена величиной 1,2 – 1,3 мкг/мл.
При приеме больным остеоартрозом глюкозамина 1500 мг внутрь, не менее 14 дней, ежедневно, в виде капсул или раствора, средняя концентрация глюкозамина в плазме крови человека достигнет величины не менее 1,3 мкг/мл, средняя концентрация в синовиальной жидкости воспаленного сустава человека составит величину не менее 0,7 – 0,8 мкг/мл.
Таким образом, средняя концентрация глюкозамина в синовиальной жидкости воспаленного сустава в течение перорального курса лечения (прием внутрь в дозе 1500 мг глюкозамина в сутки, в течение 14 дней) может быть оценена величиной 0,7 – 0,8 мкг/мл.
При нанесении препарата Хондроксид® Максимум, крем с ТГК однократно, средняя концентрация в плазме крови в течение 4 часов после каждого нанесения ТГК будет составлять величину 0,62 – 1,04 мкг/мл.
Далее есть два пути для оценки эффективности стандартного курса лечения ТГК. Если взять за основу расчета зависимости, полученные для перорального введения, то получатся следующие величины. Поскольку уровень средней концентрации глюкозамина в плазме крови после однократного нанесения очень близок к величинам, получаемым при однократном пероральном введении (0,6 мкг/мл), а частота введения в 3 раза выше, то с большой долей вероятности можно применить механизм накопления глюкозамина в плазме крови и синовиальной жидкости сустава. Тогда, сделав предположение, что в 3 раза большая частота введения приведет к концентрации в 3 раза большей, получим вывод, что после курса лечения препаратом Хондроксид® Максимум, крем с ТГК в течение 14 дней, средняя концентрация в плазме крови может составить величину не менее 1,8 – 3,1 мкг/мл, а в синовиальной жидкости воспаленного сустава величину порядка 0,9 – 1,5 мкг/мл или в среднем 1,2 мкг/мл.
Если взять за основу расчета зависимости, полученные для инъекционной модели введения, то получатся следующие величины. Средняя концентрация глюкозамина при нанесении ТГК примерно в 1,6 раза ниже, чем при инъекционном введении, поэтому средняя концентрация глюкозамина в синовиальной жидкости будет примерно во столько же раз ниже и составит величину 0,17 мкг/мл для здорового сустава. С учетом информации, о том, что уровень максимальной концентрации глюкозамина в синовиальной жидкости воспаленного сустава примерно в 5 раз выше, чем в интактном, то среднюю концентрацию в синовиальной жидкости воспаленного сустава можно оценить величиной 0,8 – 0,9 мкг/мл для больного сустава. Если учитывать, что с каждым нанесением ТГК (примерно каждые 6-8 часов) концентрация глюкозамина в синовиальной жидкости воспаленного сустава будет восстанавливаться до максимально возможного уровня, то можно сделать вывод, что концентрация глюкозамина в синовиальной жидкости воспаленного сустава в этом случае будет практически поддерживаться на уровне 0,7 – 0,8 мкг/мл или в среднем 0,75 мкг/мл.
Таким образом, средняя концентрация глюкозамина в синовиальной жидкости воспаленного сустава в течение курса лечения препаратом Хондроксид® Максимум, крем с ТГК (нанесение крема 3 раза в день в количестве 3 -3,5 г в течение 14 дней) может быть оценена величиной (0,7–1,5) мкг/мл.
ВЫВОДЫ
1. Экспериментально выявлено, что при нанесении на кожу крысам линии Спраг-Доули препарата Хондроксид® Максимум, крем с глюкозамином в дозе 400 мг/кг, 3 раза в день, ежедневно, в течение недели, количество глюкозамина, введенного в плазму крови с помощью Трансдермального Глюкозаминового Комплекса, составило 61,6 % от полученного при разовой инъекции 4% раствора Глюкозамина сульфата калия хлорид животному в дозе 400 мг/кг.
2. Средняя величина удельной диффузии глюкозамина при нанесении препарата Хондроксид® Максимум, крем с Трансдермальным Глюкозаминовым Комплексом на кожу животного в дозе 0,033 г/см² равная 26,9 мкг/см²/час сопоставима с литературными данными по скорости чрезкожного переноса в экспериментах in vitro, которая находится в пределах от 19,2±0,6 мкг/см²/час до 48,2±1,9 мкг/см²/час.
3. Сопоставительный анализ литературных и экспериментальных данных, а также расчеты на их основе позволили сделать вывод, что в процессе лечения в соответствии с инструкцией на препарат Хондроксид® Максимум расчетная средняя концентрация глюкозамина в синовиальной жидкости воспаленного сустава может составлять величину (0,7–1,5) мкг/мл, что в 10-75 раз выше концентрации эндогенного глюкозамина в синовиальной жидкости сустава человека (0,02-0,07) мкг/мл. Эта величина сравнима с уровнем, достигаемым инъекционными формами глюкозамина и превышает до 2 раз уровень, достигаемый пероральными формами глюкозамина.
Relative bioavailability and penetration of glucosamine after topical treatment by Hondroxid® Maximum transdermal glucosamine complex in comparison with oral, injectable routes in experiment on the rats.
Blair Yasso1, Yinghe Li 2, Asafov Alexander3; Melnikova N.B.4, Muchina I.V.5
1MB Research Laboratories, 1765 Wentz Road, Spinnerstown, PA 18968, USA, Blair Yasso, B.S., Study Director;
2Alliance Pharma, Inc., 17 Lee Blvd, Malvern, PA 19355, USA, Yinghe Li, Bioanalytical Principal Investigator;
3Foura Pacific Pte Ltd, (Singapore), 35 Selegie Road #10-05, Parklane Shopping Mall
Singapore 188307, Asafov Alexander, R&D, CEO;
4 Department of pharmaceutical chemistry of NSMA Russian Ministry of Health (Head of department – Professor, Dr. Melnikova N.B, Nizhny Novgorod, Rodionova str, 293)
5Central Research Laboratory of NSMA Russian Ministry of Health (Head of Central Research Laboratory — Professor, Dr. Mukhina I.V., Nizhny Novgorod, Gagarin Avenue, 70)
Key words:
relative bioavailability, glucosamine sulfate, transdermal glucosamine complex, micellar transdermal delivery system
SUMMARY
A comparison of the relative bioavailability and intensity of penetration of glucosamine sulfate in oral, injection and topical administration of the dosage form Hondroxid® Maximum as a cream containing micellar system for transdermal delivery of glucosamine in the experiment by Sprague-Dawley rats was carried out. On the base on the pharmacokinetic profiles data of glucosamine in rat blood plasma with daily administration in 3 times a day for 1 week by cream Hondroxid® Maximum 400 mg/kg and the single injection solution of 4% Glucosamine sulfate 400 mg/kg was found that the relative bioavailability was 61.6 %. Calculated penetration rate of glucosamine in the plasma through the rats skin in 4 hours, equal to 26.9 μg/cm2 ∙ h, and the penetration of glucosamine through the skin into the plasma after a single dose of cream in 4 hours was 4.12 %.
Comparative analysis of literature and experimental data and calculations based on them suggest that medicine Hondroxid® Maximum, cream with transdermal glucosamine complex in the treatment in accordance with the instructions can provide an average concentration of glucosamine in the synovial fluid of an inflamed joint in the range (0.7-1.5) µg/ml, much higher than the concentration of endogenous glucosamine human synovial joint fluid (0.02-0.07 µg/ml).
By theoretical calculations taking into account experimental data it is shown that the medicine Hondroxid® Maximum can reach the bioavailability level of the modern injection forms and exceed the bioavailability level of modern oral forms of glucosamine up to 2 times.
СПИСОК ЛИТЕРАТУРЫ
1. Р.Д. Альтман, Клиническая Фармакология
,
2
(4), 359-371 (2009)
2. M.L. Tiku, H. Narla, M. Jain, P. Yalamanchili, Arthritis Research & Therapy, 9(4), R76, 1-10 (2007).
3. C. Valvason, E. Musacchio, , A. Pozzuoli, et al., Rheumatology, 47, 31-35 (2008).
4. В.В. Береговых, Н.В. Пятигорская, Ю.А. Прудкевич, С.А. Кедик, Вестник МИТХТ,
7
(5), 17-22 (2012).
5. A. Sharma and S. Arora, World Journal of Pharmacy and Pharmaceutical Sciences, 2(6), 6448-6462 (2013).
6. Z. Liang, J. Leslie, A. Adebowale, et al., Journal of Pharmaceutical and Biomedical Analysis, 20(5), 807-814 (1999).
7. Руководствопопроведениюдоклиническихисследованийлекарственныхсредств
. Ч. 1, Гриф и К, Моcква (2012).
8. B. Van Ravenzwaay and Е. Leibold, Human & Experimental Toxicology, 23, 421-430 (2004).
9. C.G. Jackson, A.H Plaas, J. D. Sandy, et al., Osteoarthritis and Cartilage, 18, 297-302 (2009).
10. M. Meulyzer, P.Vachon, F. Beaudry, et al, Osteoarthritis Cartilage, 16(9), 973-979 (2008)
11. M. Meulyzer, P. Vachon, F. Beaudry, et al, Osteoarthritis Cartilage, 17(2), 228-34 (2009)
12. S. Persiani E. Roda, L.C. Rovati, et al, Osteoarthritis Cartilage, 13(12), 1041-9 (2005)
13. S. Persiani, R. Rotini, G. Trisolino,et al, Osteoarthritis Cartilage, 15(7), 764-72 (2007)