Ожирение
– это не эстетическая (или косметологическая) проблема, а хроническое заболевание, проявляющееся, в первую очередь, через накопление избыточной жировой ткани в организме. Набранный лишний вес часто является следствием нарушения обменных процессов, при этом он сам выступает причиной различных патологий. Так, избыточная масса тела способствует развитию или усугубляет течение сердечно-сосудистых заболеваний, заболеваний суставов, а также сахарного диабета, желчнокаменной болезни, подагры, приводит к нарушению половой функции. Поэтому проблема избыточной жировой ткани является комплексной, и пытаться справиться с ожирением самостоятельно – с помощью советов «знающих» людей – порою просто опасно. Бороться с лишним вес необходимо под руководством врача.
Что считать ожирением и каким оно бывает
Для определения отклонения массы тела от нормы используется показатель индекс массы тела
– ИМТ. Он рассчитывается как отношение массы тела (в килограммах) к росту человека (в метрах), возведенному в квадрат и измеряется в единицах кг/м².
ИМТ применяется для характеристики людей в возрасте от 18 до 65 лет. Если ИМТ менее 18,5 кг/м², диагностируется дефицит массы тела. Диапазон нормы: от 18,5 до 24,9 кг/м². ИМТ в диапазоне 25-29,9 кг/м² показывает наличие избыточной массы тела, предожирение. Это ещё не болезнь, но сигнал, что человеку следует взять свой вес под контроль. При ИМТ выше 30 кг/м² диагностируется ожирение: от 30 до 34,9 кг/м² — I степени, от 35 до 39,9 кг/м² – II степени, свыше 40 кг/м² — III степени. С увеличением степени ожирения возрастает риск развития сопутствующих заболеваний – от высокого до чрезвычайно высокого, то есть сопутствующие заболевания становятся попросту неизбежны.
Различают также типы ожирения
:
Абдоминальный
(от латинского слова abdomen – «живот») – когда избыточная жировая ткань формируется в области живота или верхней части туловища. Этот тип ожирения также называют «мужским», поскольку он свойственен в большей степени мужчинам, или ожирением по типу «яблока». При абдоминальном ожирении возрастает риск сердечно-сосудистых заболеваний.
Бедренно-ягодичный
– нижний тип ожирения, более свойственен женщинам. Его ещё называют ожирением по типу «груши». Нижний тип ожирения часто сопровождается заболеваниями позвоночника, а также суставов и вен нижних конечностей.
Смешанный
, когда избыточная жировая ткань распределяется равномерно по всему телу.
Определить тип ожирения можно, измерив талию и бедра. Если у мужчины отношение окружности талии к окружностям бедер больше 1,0 (ОТ/ОБ>1), то диагностируется абдоминальный тип. У женщин абдоминальный тип устанавливается при ОТ/ОБ>0,85.
Окружность талии также используется в диагностике ожирения. Если у мужчин ОТ>102 см., а у женщин ОТ>88 см., то это – абдоминальное ожирение. Однако уже при ОТ>94 у мужчин и ОТ>80 см. у женщин повышается риск развития диабета 2-го типа и сердечно-сосудистых заболеваний.
Лечение ожирения может проводиться в круглосуточном Терапевтическом стационаре на Баррикадной в рамках лечебно-оздоровительной программы Снижение веса. Курс терапии может составлять от 1 до 10 дней.
Моногенные дефекты и эндокринный дисбаланс
Мы выяснили, что дисфункция лептин-меланокортинового пути приводит к нарушению регуляции голода/насыщения и является прямой причиной ожирения, но усиление аппетита — не единственная проблема. Отсутствие лептина или сигнала от лептина сопровождается следующими нарушениями в эндокринной системе:
- Активация гипоталамус-гипофизарно-надпочечниковой оси с усилением синтеза кортизола.
- Уменьшение активности щитовидной железы с явлениями гипотиреоза.
- Угнетение репродуктивной функции и синтеза половых гормонов с признаками гипогонадизма.
- Снижение секреции гормона роста.
Как перечисленные выше эндокринные нарушения влияют на массу тела, рассказывается в следующих разделах статьи. Если вкратце, даже одно из перечисленных нарушений может стать причиной морбидного ожирения, а комплексная гормональная дисфункция гарантировано приводит к значительному увеличению массы тела.
Обзор лептин-меланокортинового пути показывает, что с причинами ожирения не все просто. Существуют факторы, о которых пару десятков лет назад медицина ничего не знала. Каждый год появляются новые данные, которые проливают свет на истинные причины ожирения, связанные с унаследованными дефектами и генетическими нарушениями регуляции пищевого поведения.
Причины ожирения
Ожирение может быть обусловлено заболеваниями эндокринной системы или органов пищеварения. Однако основная причина состоит в том, что человек получает с пищей большее количество энергии, чем расходует его организм.
Факторы, способствующие ожирению
:
- нарушение пищевого поведения (привычка много есть);
- стрессы (человеку свойственно «заедать» стресс, компенсируя негатив положительными эмоциями, возникающими при употреблении вкусной пищи);
- бессонница (бодрствуя ночью, человек склонен организовать себе внеочередную трапезу, повышая суточное потребление калорий);
- малоподвижный образ жизни;
- отказ от курения (привычная сигарета заменяется сладким, орехами, семечками и т.п.);
- семейная традиция;
- алкоголизм;
- приём некоторых медицинских препаратов;
- беременность и роды.
Моногенное ожирение
Что такое моногенное ожирение? Многие читатели сталкиваются с подобным термином впервые, поэтому он требует отдельного пояснения.
Моногенное ожирение — заболевание, обусловленное мутацией гена, кодирующего один из элементов лептин-меланокортинового пути регуляции голода и насыщения. Моногенное ожирение сопровождается булимией и прогрессирующим увеличением массы тела.
В этом определении читатель без медицинского образования уже столкнулся с несколькими непонятными терминами. Чтобы все стало ясно и понятно, далее идет подробное описание терминов в упрощенной форме.
Что такое лептин-меланокортиновый путь?
Одним из ключевых регуляторов аппетита, чувства голода и насыщения является лептин-меланокортиновый путь. Главные компоненты этого пути:
- Лептин — гормон жировой ткани, который вырабатывается в ответ на поступление пищи.
- Меланокортины — медиаторы ЦНС, которые стимулируют центры насыщения и подавляют центры голода в головном мозге. Меланокортины — ключевые регуляторы пищевого поведения и энергетического баланса в нашем организме.
Между лептином и меланокортинами существует прямая связь: лептин усиливает синтез меланокортинов. Процесс регуляции пищевого поведения упрощенно выглядит следующим образом:
- Прием пищи усиливает синтез лептина.
- Лептин действует на специфические рецепторы в гипоталамусе и стимулирует синтез меланокортина.
- Меланокортин активирует центры насыщения, подавляет центры голода.
- Человек чувствует насыщение и прекращает прием пищи.
Это упрощенная схема регуляции пищевого поведения, поскольку в процессе участвует больше факторов. К примеру, секрецию меланокортина также стимулирует гипергликемия, инсулин, другие гормоны. Лептин действует на AgPR/NPY-нейроны, активация которых усиливает чувство голода. Лептин блокирует эти нейроны, оказывая тем самым анорексигенное действие (снижает аппетит).
Справка.
AgPR/NPY-нейроны: клетки ЦНС, активация которых сопровождается орексигенным эффектом (усиление аппетита).
Какое отношение это имеет к причинам ожирения?
Самое прямое. Ученые доказали, что в работе лептин-меланокортиновой системы есть несколько ключевых элементов; генетический дефект одного звена приводит к гиперфагии (переедание) и злокачественному ожирению. Генетические дефекты, затрагивающие один единственный ген, принято называть моногенными.
Какие дефекты могут привести к развитию моногенного ожирения?
К развитию морбидного ожирения могут привести мутации в генах, кодирующих:
- лептин (LEP);
- рецепторы к лептину (LEPR) в клетках головного мозга;
- рецепторы тирозинкиназы 2 типа (NTRK-2);
- проопиомеланокортина (POMC);
- меланокортиновые рецепторы (MC4-R).
Все перечисленные выше факторы являются важными элементами лептин-меланокортинового пути регуляции пищевого поведения. На самом деле, звеньев в этой цепи больше, но в статье приводятся только ключевые элементы, иначе вместо научно-популярного материала получится научный, слишком трудный для понимания.
Итак, причиной ожирения, равно как и истинной причиной переедания, может быть мутация гена, отвечающего за синтез лептина в жировых клетках. Дефект гена, кодирующего рецепторы к лептину в POMC-нейронах и AgPR/NPY-нейронах головного мозга, приведет к аналогичным результатам: лептин в организме пациента вырабатывается, но центры головного мозга к нему нечувствительны.
Причиной ожирения может быть дефект рецептора, отвечающего за внутриклеточную передачу сигнала. Дело в том, что рецепторы к лептину находятся на поверхности POMC-нейронов, вырабатывающих меланокортин. Внутриклеточная передача осуществляется при участии тирозинкиназы, дефект которой приводит к дисфункции всего лептин-меланокортинового пути.
Причиной ожирения может быть моногенный дефект гена, кодирующего сам проопиомеланокортин в POMC-нейронах. Такая мутация приводит к тому, что меланокортины попросту не образуются. Лептин есть, рецепторы есть, но система не работает из-за отсутствия промежуточного компонента. Результат? Неконтролируемый аппетит и ожирение.
Наконец, причиной ожирения может быть мутация гена меланокортиновых рецепторов MC4-R. С этими рецепторами взаимодействует меланокортин. Если в рецепторах MC4-R есть дефект, передача сигнала в центры насыщения становится невозможной. Результатом моногенной мутации также будет булимия с прогрессирующим набором веса.
Методы диагностики ожирения
Лечение ожирения начинается с полного обследования состояния здоровья и выявления причины избыточного веса
.
Рекомендуется комплекс диагностических процедур, включающий такие методы, как:
Антропометрия
Антропометрия при ожирении включает в себя подсчет ИМТ, измерение окружности талии и окружности бедер, оценка толщины подкожной жировой клетчатки с помощью калипера.
Биоимпедансометрия
Ожирение также может быть диагностировано с помощью инструментальных методов, прежде всего, — биоимпедансометрии. С помощью специального прибора измеряется электрическое сопротивление тела, что даёт возможность рассчитать ИМТ, жировую и безжировую массу, активную клеточную массу, общую жидкость в организме, а также отдельно внутриклеточную и внеклеточную жидкость.
Лабораторная диагностика
При ожирении проводится биохимический анализ крови (показатели: глюкоза крови, гликированный гемоглобин, холестерин, ЛПНП, ЛПВП, креатинин, билирубин, мочевая кислота, гамма ГТ), а также анализ на гормоны (показатели: ТТГ, Т4, лептин, инсулин, витамин Д, пролактин, ЛГ, ФСГ, тестостерон, эстрадиол). Данные исследования могут быть объединены в специальном профиле «Контроль веса»).
Ультразвуковые исследования
При ожирении проводятся ультразвуковые исследования органов брюшной полости, органов малого таза (у женщин, у мужчин – предстательной железы), щитовидной железы.
Подробнее о методе диагностики
ЭКГ
При ожирении возрастает риск сердечно-сосудистых заболеваний. ЭКГ позволит оценить, сказалось ли увеличение веса на работе сердца. При необходимости могут потребоваться дополнительные исследования.
Подробнее о методе диагностики
Записаться на диагностику Чтобы точно продиагностировать заболевание, запишитесь на прием к специалистам сети «Семейный доктор».
Ожирение при гипогонадизме
Гипогонадизм — синдром, который развивается при снижении секреции половых гормонов тестикулярной тканью. Причиной первичного гипогонадизма является патология тестикул, вторичный гипогонадизм развивается в результате снижения выработки тропных гормонов гипофиза или рилизинг-факторов гипоталамуса.
Ожирение при гипогонадизме развивается по женскому типу, с преимущественной локализацией избытка жировой ткани на бедрах, ягодицах, животе. У пациента слабо развиты вторичные половые признаки, часто недоразвиты яички, предстательная железа. У многих не растут волосы на теле и лице. Возможный симптом — истинная гинекомастия. Либидо снижено, развивается импотенция.
Диагностика гипогонадизма основана на развернутом анализе гормонального профиля. Лечение направлено на устранение причин заболевания.
Методы лечения ожирения
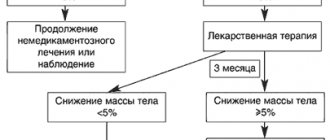
Цели, которые преследует лечение, могут быть различны. Это:
- уменьшение массы тела
(безопасным для организма является уменьшение массы не более чем на 0,5-1 кг. в неделю); - поддержание достигнутого уровня массы тела
(после похудания) и предотвращение ее повторного увеличения; - лечение сопутствующих заболеваний
или снижение риска их возникновения.
Когда и к какому врачу необходимо обращаться при ожирении
Лечение ожирения осуществляет врач-эндокринолог. Именно он проводит первичное обследование пациента, дает направления на необходимые диагностические исследования, а при необходимости направляет к другим врачам-специалистам (гастроэнтерологу, гинекологу, урологу, неврологу, кардиологу, офтальмологу). Для изменения образа жизни иногда требуется консультация врача-психотерапевта.
Лечение ожирение необходимо, если Ваш ИМТ (индекс массы тела) более 30 кг/м². Но иногда лечение следует начинать и при ИМТ>27 кг/м², если:
- Вы планируете беременность;
- имеется абдоминальное ожирение (отношение окружности талии к окружности бедер у мужчин более 1, у женщин – более 0,85);
- Вы страдаете сахарным диабетом 2-го типа или артериальной гипертонией;
- есть наследственная предрасположенность к диабету 2-го типа или артериальной гипертонии;
- повышен уровень холестерина в крови (угроза атеросклероза);
- беспокоят заболевания опорно-двигательного аппарата (суставов, позвоночника).
Комплекс терапии ожирения включает в себя:
Изменение образа жизни
Лечение ожирения будет неэффективно без изменения образа жизни. Прежде всего, необходимы преодоление пищевых привычек, способствующих перееданию, а также согласованная с врачом повышенная физическая активность.
Коррекция диеты
Необходимо ограничение суточного потребления энергии до 1200-1500 калорий. Переход на диету должен осуществляться обязательно под контролем врача.
Медикаментозное лечение
При необходимости по назначению врача-эндокринолога может проводиться медикаментозное лечение.
Лечение сопутствующих заболеваний
Лечение сопутствующих заболеваний может проводиться как амбулаторно, так, если это необходимо, и в условиях дневного стационара.
Записаться на прием Не занимайтесь самолечением. Обратитесь к нашим специалистам, которые правильно поставят диагноз и назначат лечение.
Медикаментозное лечение ожирения у больных метаболическим синдромом
В последние годы в большинстве стран мира распространенность ожирения среди населения неуклонно растет. Наша страна не исключение: по данным Эндокринологического диспансера департамента здравоохранения г. Москвы, количество лиц, страдающих ожирением, за последние 10 лет увеличилось среди взрослого населения на 51%, среди подростков – на 75% и на 66% среди детей.
Рисунок 1. Динамика показателей углеводного обмена на фоне 24-недельной терапии препаратом Ксеникал
Рисунок 2. Динамика чувствительности тканей к инсулину (Si) на фоне терапии препаратом Ксеникал
Рисунок 3. Динамика показателей липидного обмена на фоне 24-недельной терапии препаратом Ксеникал
Рисунок 4. Динамика средних показателей суточного мониторирования АД на фоне 24-недельной терапии препаратом Ксеникал
Таблица. Динамика показателей ЭхоКГ на фоне терапии Ксеникалом
Рисунок 5. Динамика перфузии головного мозга у пациентов с МС на фоне снижения массы тела на 16 кг (14%) при 24-недельном приеме препарата Ксеникал
Рисунок 6. Орлистат влияет на все проявления метаболического синдрома
Особую опасность представляет собой центральный тип ожирения с преимущественным отложением жира в абдоминальной области, который ассоциируется с инсулинорезистентностью (ИР), нарушением углеводного, липидного обмена, артериальной гипертонией (АГ) и повышенной сердечно-сосудистой заболеваемостью. Все эти нарушения патогенетически взаимосвязаны и объединены в понятие метаболический синдром (МС). Установлено, что наличие МС в 3-6 раз повышает риск развития сахарного диабета (СД) 2 типа (6) и АГ (9), а сердечно-сосудистая заболеваемость и смертность у людей с МС существенно выше по сравнению с лицами без него (4).
Первостепенной и патогенетически обоснованной задачей терапии больных с МС являются меры, направленные на лечение ожирения и нормализацию метаболических нарушений. Немедикаментозные мероприятия нацелены на снижение массы тела, изменение стереотипов питания, отказ от вредных привычек, таких как курение и злоупотребление алкоголем, повышение физической активности, т.е. на формирование так называемого здорового образа жизни. Немедикаментозное лечение является более физиологичным, доступным и не требует больших материальных затрат, в то же время необходимы значительные усилия со стороны врачей и самого больного, так как проведение данного вида лечения связано с затратами дополнительного времени.
В ряде случаев необходимо к немедикаментозным методам лечения ожирения добавлять лекарственные препараты, снижающие вес. Существуют показания к их назначению, а именно:
- индекс массы тела (ИМТ) ≥ 30 кг/м2;
- или ИМТ ≥ 27 кг/м2 в сочетании с абдоминальным ожирением, наследственной предрасположенностью к СД 2 типа и наличием факторов риска сердечно–сосудистых осложнений (дислипидемия, АГ и СД 2 типа).
Лекарственные средства для снижения веса подразделяются на группы препаратов центрального действия, периферического действия и различного действия (гормон роста, андрогены).
Большинство препаратов центрального действия, снижающих аппетит, было снято с производства из-за побочных эффектов, зачастую приводящих к гибели больных, наиболее тяжелым из которых являлось возникновение тяжелой легочной гипертонии. Эти эффекты возникали, как правило, вследствие системного действия данных лекарственных средств.
История создания и внедрения в лечебную практику «аноректиков» – препаратов для уменьшения аппетита – драматична (7). Первым препаратом, предложенным для снижения веса, был хорошо известный всем амфетамин. Это было в 1938 году. Но вскоре стали известны неблагоприятные побочные эффекты при его назначении – выраженное стимулирующее действие на ЦНС, а также синдром отмены, возникающий при прекращении его приема. В настоящее время амфетамин для лечения ожирения не применяется.
Следующая «черная полоса» истории применения аноректиков связана с эпидемией первичной легочной гипертензии (ПЛГ), разра-зившейся в середине 1960-х годов в Швейцарии, Германии и Австрии. Она возникла после распространения аминорекса фумората. ПЛГ относится к наиболее тяжелым сердечно-сосудистым заболеваниям. К счастью, эта патология встречается очень редко – в среднем в 1-2 случаях на миллион населения, но при назначении некоторых аноректиков частота ее увеличивается многократно. Так, в работах группы американских пульмонологов было показано, что частота развития ПЛГ при применении аминорекса возрастает приблизительно в 30 раз.
В 1980-90-х годах препаратами выбора для лечения ожирения были фенфлюрамины, препараты, влияющие на обмен серотонина, а также фентермин, обладающий стимулирующим воздействием на симпатическую нервную систему. Популярностью также пользовалась комбинация фентермина и фенфлюрамина – так называемый препарат фен-фен. Эти лекарственные средства привлекали своей высокой эффективностью и хорошей, по сравнению с предшественниками, переносимостью. Но, к сожалению, стимулирующее влияние на симпатическую нервную систему, а также токсическое влияние высоких концентраций серотонина приводило к дисфункции и повреждению сосудистого эндотелия, в первую очередь легких, что сопровождалось повышением сосудистого тонуса и развитием легочной гипертензии. Фенфлюрамины, кроме того, в ряде случаев приводили к возникновению патологии клапанного аппарата сердца (10). В ряде исследований также было показано, что фенфлюрамины могут повышать системное давление и увеличивать частоту сердечных сокращений (ЧСС), что является неблагоприятным моментом у пациентов с АГ (2). Частота развития легочной гипертензии при назначении фенфлюраминов была значительно ниже, чем при использовании аминорекса и, как правило, побочные эффекты при назначении этих препаратов развивались после 6 месяцев постоянного применения. Но обеспокоенная медицинская общественность обратилась к контролирующим органам с просьбой запретить продажу этих лекарств, и с 1997 года в ряде стран их распространение запрещено, а в других срок применения ограничен 3-6 месяцами.
Предыдущие неудачи и желание иметь как можно более безопасный и эффективный препарат заставили ученых идти другим путем – создать препарат не центрального, а местного действия. Усилия фармацевтов были направлены на создание лекарства, действие которого носило бы локальный характер. Таким препаратом является Ксеникал (орлистат 120 мг) – лекарственное средство для лечения ожирения с несистемным эффектом.
В 2009 г. во втором пересмотре рекомендаций ВНОК по диагностике и лечению МС эксперты предложили использовать два лекарственных препарата для лечения ожирения. Это препарат периферического действия – орлистат – и препарат центрального действия – сибутрамин.
Сибутрамин отличается от своих предшественников фенфлюраминов тем, что в меньшей степени влияет на дофаминовый обмен и не влияет на холинергические процессы. Прием сибутрамина приводит к быстрому наступлению чувства насыщения и снижению аппетита. Однако уже первые исследования показали, что применение сибутрамина у лиц, не страдающих АГ, может сопровождаться повышением АД на 3-4 мм рт. ст. и повышением ЧСС. Это его свойство повышать АД и ЧСС ограничивало применение сибутрамина у пациентов с АГ, МС и повышенным риском сердечно-сосудистых заболеваний.
В 2009 году закончилось рандомизированное, двойное слепое, плацебо-контролируемое исследование SCOUT (Sibutramine Cardiovascular Outcomes Trial), в которое было включено более 10000 пациентов с избыточной массой тела и ожирением, с СД или коронарной болезнью сердца в анамнезе, поражением периферических артерий или инсультом, а также с другими факторами сердечно-сосудистого риска. Исследование было предназначено для оценки безопасности длительного приема сибутрамина у данной категории больных.
При анализе первичных конечных точек этого исследования (случаи инфаркта миокарда, инсульта, реанимации при остановке сердца или смерти) выявилось, что этот показатель был 11,4% в группе пациентов, получавших сибутрамин, и 10% в группе плацебо. Таким образом, риск сердечно-сосудистых осложнений был достоверно выше у пациентов, принимающих сибутрамин (p = 0,023) (5).
Полученные в исследовании SCOUT данные имеют большое клиническое значение, так как у пациентов с избыточной массой тела и ожирением имеется изначально высокий риск развития сердечно-сосудистых осложнений. Таким образом, в свете новых данных использование сибутрамина для лечения ожирения у больных с МС противопоказано. Европейское медицинское агентство (ЕМЕА) завершило анализ безопасности лекарственных препаратов, содержащих сибутрамин. Европейский комитет по лекарственным препаратам (CHMP) пришел к заключению, что риск при использовании данных препаратов превышает пользу и рекомендовал приостановить действие лицензии на их продажу на территории Европейского Союза.
С 21 января 2010 г. сибутрамин запрещен к применению у пациентов с сердечно-сосудистыми заболеваниями в анамнезе, что было объявлено Управлением контроля качества пищевых продуктов и лекарств (FDA). Опираясь на новые данные исследования SCOUT, комитет FDA обязал внести в инструкцию по применению препарата новые дополнительные противопоказания.
В России лекарственный препарат сибутрамин зарегистрирован под следующими торговыми наименованиями: Меридиа (Abbot, Германия), Редуксин (ООО «Озон», Россия), Голдлайн (Ranbaxy, Индия), Слимия (Torrent, Индия), Линдакса (Zentiva, Чехия).
Таким образом, у врачей всего мира в арсенале остается единственный безопасный препарат для лечения ожирения у больных МС – орлистат.
Ксеникал (орлистат 120 мг) – это препарат периферического действия, который тормозит всасывание жиров пищи в желудочно-кишечном тракте (ЖКТ) вследствие ингибирования желудочно-кишечных липаз – ключевых ферментов, участвующих в гидролизе триглицеридов пищи, высвобождении жирных кислот и моноглицеридов. Это приводит к тому, что около 30% триглицеридов пищи не переваривается и не всасывается, что позволяет создать дополнительный дефицит калорий по сравнению с применением только гипокалорийной диеты. После отмены орлистата активность липаз быстро восстанавливается. Орлистат не действует на другие ферменты ЖКТ, не влияет на всасывание углеводов, белков и фосфолипидов. Препарат оказывает собственный дополнительный гиполипидемический эффект, поскольку, подавляя липазы ЖКТ, он снижает количество свободных жирных кислот в кишечнике и тем самым уменьшает растворимость и всасывание холестерина. Как было показано в ряде исследований, орлистат уменьшает уровень холестерина в большей степени, чем этого можно было ожидать только из-за уменьшения массы тела на фоне его применения.
Ксеникал используется для лечения ожирения уже более 11 лет, за это время было проведено более 100 клинических исследований, результаты которых позволили не только оценить эффективность и безопасность препарата для лечения ожирения по степени снижения массы тела, но также оценить его влияние на кардиометаболические факторы риска.
У пациентов, получавших орлистат в сочетании с гипокалорийной диетой, снижение массы тела составляло 4,7-10,3 кг, в то время как пациенты, получавшие плацебо, теряли от 0,9 до 6,4 кг (р
Были проведены многочисленные исследования по оценке эффективности терапии орлистатом у пациентов с МС. Так, по данным этих исследований было выявлено, что терапия Ксеникалом приводила к достоверно большему снижению уровня общего холестерина и фракции ХС ЛПНП по сравнению с группой плацебо. Также во всех сравнительных исследованиях было отмечено достоверное снижение АД (8).
В США проводилось исследование влияния препарата Ксеникал на массу тела и состояние углеводного обмена у больных СД 2 типа, принимавших препараты сульфанилмочевины. Результаты этого исследования показали, что орлистат достоверно снижает массу тела у больных СД и ожирением (3). На фоне терапии орлистатом заметно падал уровень гликемии натощак и снижалась концентрация гликированного гемоглобина. Одним из наиболее важных результатов этого исследования явилось то, что у больных, принимавших орлистат, снижалась потребность в препаратах сульфанилмочевины для компенсации СД.
Кроме того, анализ данных этого исследования показал, что среди пациентов с нормальной толерантностью к глюкозе на фоне приема орлистата в течение 2 лет не было выявлено ни одного нового случая СД 2 типа, в то время как в группе плацебо СД 2 типа развивался в 1,5% случаев. Нарушение толерантности к глюкозе определялось с течением времени в группе плацебо в 2 раза больше, чем в группе орлистата.
Результаты проспективного, рандомизированного, плацебо-контролируемого исследования XENDOS с участием 3304 тучных пациентов подтвердили эффективность и безопасность длительной терапии (непрерывно в течение 4 лет) препаратом Ксеникал у больных ожирением. К концу четвертого года терапии уровень ХС ЛПНП снизился на 12,8%, а в группе плацебо – на 5,1%. Систолическое АД у пациентов, принимавших орлистат, снизилось в среднем на 4,9 мм рт. ст. и диастолическое на 2,6 мм рт. ст., что было достоверно выше по сравнению с пациентами, принимавшими плацебо (3,4 мм рт. ст. и 1,9 мм рт. ст. соответственно). Риск развития СД 2 типа уменьшился на 37% в группе орлистата по сравнению с группой плацебо (11).
Способность орлистата частично блокировать всасывание жиров пищи послужила основанием для проведения исследования по изучению влияния его длительного применения на концентрацию жирорастворимых витаминов. Его результаты показали, что прием препарата в течение 2 лет сопровождался незначительным изменением концентрации жирорастворимых витаминов (A, D, E, K) и в среднем их уровень сохранялся в пределах нормальных значений. Кроме того, было установлено, что снижение концентрации витаминов наблюдалось лишь в первый месяц лечения, в дальнейшем она сохранялась неизменной до конца исследования. Ни у одного из пациентов в исследовании не наблюдалось симптомов гиповитаминоза.
Лабораторных и клинических признаков нарушений кальци-евого обмена на фоне длительного применения орлистата (Ксеникал) также не наблюдалось. В нескольких работах было показано, что усиления остеокласт-остеобластной активности или снижения костной массы при длительном назначении орлистата не было. На основании этих наблюдений был сделан вывод, что орлистат не оказывает влияния на обменные процессы в костной ткани.
Терапия Ксеникалом, как показал ряд исследований, не приводит к увеличению риска образования камней в желчевыводящих путях. Эти нежелательные явления встречались лишь в 1% случаев как в группе орлистата, так и в группе плацебо. В ряде других исследований было установлено, что препарат не вызывал клинически значимых нарушений физиологических процессов в ЖКТ.
Клинические исследования препарата Ксеникал выполнены на огромном контингенте больных, более 30000 человек участвовали в этих исследованиях, среди них были пациенты с СД 2 типа, с нарушенной толерантностью к глюкозе и с другими множественными факторами сердечно-сосудистого риска. В связи с этим можно с уверенностью говорить, что в настоящее время данное лекарственное средство является наиболее широко и тщательно изученным препаратом для лечения ожирения.
Положительный опыт применения Ксеникала в Отделе системных гипертензий НИИ кардиологии имени А.Л. Мясникова РК НПК МЗ РФ у больных МС еще раз подтвердил его высокую эффективность и безопасность для лечения пациентов с высоким сердечно-сосудистым риском (1). Целью данного исследования было изучение влияния снижения массы тела на фоне терапии орлистатом на показатели углеводного и липидного обменов, ИР, суточный профиль АД, гипертрофию миокарда левого желудочка и состояние перфузии головного мозга у пациентов с МС. В исследовании принимали участие 30 пациентов возрасте 39,9 ± 8,6 года с МС, средняя масса тела составила 116,5 ± 5,7 кг. Всем пациентам назначали Ксеникал в дозе 120 мг 3 раза в день во время приема пищи, давали рекомендации по умеренной гипокалорийной диете с ограничением употребления жиров.
В результате приема препарата Ксеникал на протяжении 24 недель удалось достичь значительного снижения массы тела, в среднем на 16 кг, или более чем на 14%, причем это снижение сопровождалось и уменьшением выраженности висцерального ожирения. Снижение массы тела на фоне терапии Ксеникалом приводило к достоверному снижению ИР, улучшению показателей углеводного и липидного обмена. Уровень глюкозы плазмы натощак достоверно снизился на 26% и постпрандиальный уровень – на 29% (рисунок 1).
Также отмечалось уменьшение гиперинсулинемии – исходно повышенные базальные уровни инсулина и С-пептида снизились на 54% и 32% соответственно и постпрандиальные их уровни – на 38% и 7% соответственно. На фоне приема препарата Ксеникал отмечалось достоверное повышение чувствительности периферических тканей к инсулину, что продемонстрировали результаты инсулин-модифицированного теста толерантности к глюкозе (Минимальная модель N. Bergman) (рисунок 2).
Исходно нарушенные показатели липидного обмена на фоне приема Ксеникала значимо улучшились. Достоверно снизился уровень общего ХС на 12%, ХС ЛПНП на 17,6%, повысился уровень ХС ЛПВП на 22%, и отмечалась тенденция к снижению триглицеридов (рисунок 3).
На фоне снижения массы тела, повышения чувствительности тканей к инсулину и улучшения показателей углеводного и липидного обмена достоверно снизилось АД (и систолическое, и диастолическое) как в дневное, так и в ночное время суток, и улучшился суточный профиль АД (рисунок 4). Снижение АД в результате уменьшения массы тела может быть опосредованно снижением повышенной активации СНС, ренин-ангиотензин-альдостероновой системы. Эти эффекты, вероятно, обусловлены уменьшением количества СЖК, повышением чувствительности тканей к инсулину на фоне снижения массы тела.
Через 24 недели терапии препаратом Ксеникал пациентов с МС и признаками гипертрофии миокарда левого желудочка (ГМЛЖ) она достоверно уменьшилась на фоне снижения массы тела, АД и благоприятных метаболических эффектов (см. таблицу).
Уменьшение ГМЛЖ на фоне приема Ксеникала, вероятно, обусловлено снижением массы тела, улучшением чувствительности периферических тканей к инсулину, следствием чего является снижение гиперинсулинемии, которая, вероятно, может играть значительную роль в формировании ГМЛЖ. Кроме того, снижение АД также могло оказать благотворное влияние на структурно-функциональное состояние миокарда.
Исходно сниженная перфузия головного мозга у пациентов с МС достоверно улучшилась на фоне снижения массы тела, АД, ИР и улучшения показателей углеводного и липидного обмена (рисунок 5).
Такой выраженный позитивный эффект на состояние перфузии головного мозга, скорее всего, можно связать с уменьшением ИР, улучшением углеводного и липидного обмена, которое, вероятно, привело к улучшению гемостаза и реологии крови и вызвало улучшение кровообращения не только в крупных, но и в сосудах микроциркуляторного русла. Кроме того, уменьшение ИР, возможно, привело к улучшению эндотелиальной функции и повышению эндотелий-зависимой вазодилатации.
Из нежелательных явлений у пациентов наблюдалась только стеаторея, которая, как известно, возникает лишь при превышении приема жиров с пищей более 30%. Стеаторея являлась своеобразным «индикатором» излишнего потребления жиров, и это помогало пациентам самостоятельно корректировать диету.
Высокая периферическая селективность препарата Ксеникал, отсутствие системного действия и серьезных побочных эффектов, значимое снижение массы тела, которое сопровождается снижением АД и значительным улучшением липидного и углеводного обмена, являющимися серьезными факторами сердечно-сосудистого риска, дает основание рекомендовать Ксеникал для применения в кардиологической практике. В виду того, что данный препарат положительно влияет на все проявления МС (рисунок 6), нивелируя их, Ксеникал может также успешно применяться для профилактики развития МС у здоровых лиц с избыточной массой тела.
Синдромальное ожирение
В популярных материалах, посвященных проблеме лишнего, часто фигурирует термин «генетическое ожирение». Обычно под этим термином подразумевают неспецифический набор наследственных факторов, который создает предпосылки к развитию конституционально-экзогенного ожирения. Другими словами, повышает вероятность набора веса при увеличении калорийности рациона питания.
Синдромальное ожирение — более специфическое, научное понятие. Оно характерно для истинных генетических заболеваний, при которых имеет место грубое нарушение на уровне комплексов генов или целых участков хромосом.
Примером синдромального ожирения является синдром Прадера-Вилли, при котором в геноме отсутствует фрагмент отцовской хромосомы. Ожирение развивается в детском возрасте. Дети с этим заболеванием отличаются аномально хорошим аппетитом, но они плохо растут и развиваются непропорционально.
Синдромальное ожирение также характерно для следующих генетических заболеваний:
- Синдром Альстрема.
- Синдром Дауна.
- Синдром хрупкой Х-хромосомы.
- Синдром Киллиана.
- Синдром Кохена.
- Синдром Карпентера.
- Синдром Лоуренса-Муна-Барде-Бидля.
- Другие генетические синдромы.
Гипоталамическое ожирение
Формально гипоталамическое ожирение можно отнести к предыдущей группе, то есть к эндокринному. Гипоталамо-гипофизарные структуры являются частью эндокринной системы и принимают непосредственное участие в регуляции работы желез внутренней секреции. Однако специфика данных форм заболевания позволяет вынести гипоталамическое ожирение в отдельную категорию.
При гипоталамическом ожирении причина гормонального дисбаланса находится на уровне центров головного мозга, регулирующих функцию эндокринной системы. Причиной патологических изменений может быть черепно-мозговая травма, опухолевый процесс с локализацией в подкорковых структурах, перенесенный инсульт, хирургическое вмешательство на головном мозге, инфекционное заболевание с поражением ЦНС. Впрочем, часто первопричину болезни установить не удается.
Ожирение на фоне приема лекарственных препаратов
Причиной ожирения может стать прием определенных лекарственных препаратов. С высоким риском набора веса сталкиваются пациенты, принимающие системные кортикостероиды. Лекарственные средства из этой группы часто назначают при лечении аутоиммунных заболеваний: системная красная волчанка, склеродермия, ревматоидный артрит, другие.
Пациенты проходят гормональную терапию в течение длительного времени. Назначение кортикостероидов объясняется мощным противовоспалительным действием этих препаратов. Стимуляция липогенеза — побочное действие лекарств, с которым приходится мириться, поскольку терапевтический эффект для пациентов с аутоиммунными заболеваниями более важен.
Причиной ожирения могут быть другие лекарства, например, антидепрессанты или оральные гормональные контрацептивы. Учитывая многообразие противозачаточных средств, при появлении побочного эффекта женщине стоит сменить препарат или выбрать иной метод контрацепции. Проблему с антидепрессантами необходимо решать только совместно с лечащим врачом.